Die Fälschungsschutzrichtlinie und ihre Umsetzung:Track&Trace für fälschungssichere Arzneimittel
Zum Schutz der Patienten vor gefälschten Arzneimitteln hat die EU-Kommission bereits im August 2015 den Entwurf des delegierten Rechtsakts zur Fälschungsschutzrichtlinie 2011/62/EU öffentlich gemacht (Falsified Medicines Directive, kurz FMD). Mittlerweile wurde die Verordnung (EU) 2016/161 Anfang Februar 2016 im Amtsblatt der Europäischen Union veröffentlicht. Das ist für die davon betroffenen Hersteller von verschreibungspflichtigen Arzneimitteln und für Verpackungsdienstleister eine große technische, logistische und wirtschaftliche Herausforderung: Bis Anfang Februar 2019 müssen sie die Vorgaben umgesetzt haben.
Arzneimittelfälschungen entwickeln sich weltweit zu einer immer größer werdenden Bedrohung für die Gesundheit. Da die Gewinnspannen hier noch höher sind als bei harten Drogen wie Heroin und Kokain, sind zunehmend auch weltweit operierende Fälschersyndikate involviert. Arzneimittelfälschungen sind besonders verwerflich, da sie die Gesundheit, wenn nicht sogar das Leben von Menschen gefährden, zum Beispiel im Falle von Antibiotika zur Resistenzbildung und damit zur Unwirksamkeit lebensrettender Arzneien beitragen. Last but not least verursachen sie einen hohen wirtschaftlichen Schaden.
End-to-End-Verifizierung
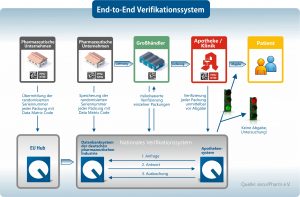
Bild: securPharm e.V.
Hier will die EU den Riegel vorschieben. Die nun veröffentlichte FMD enthält die technischen und organisatorischen Vorgaben zur Umsetzung der Sicherheitsmerkmale, die Arzneimittel künftig tragen müssen. Sie verlangt von allen 28 Mitgliedstaaten die Einführung eines Systems zur Entdeckung gefälschter Arzneimittel: Medikamentenpackungen mit unverwechselbaren Seriennummern, manipulationssichere Siegel und Echtheitsnachweise, die vor der Abgabe an den Patienten eine sogenannte End-to-End-Verifizierung jeder einzelnen Packung ermöglichen. Betroffen sind europaweit mehr als 6.000 Arzneimittelhersteller und rund 10 Milliarden rezeptpflichtiger Medikamente, die jedes Jahr verschrieben werden.
Bei Produktion und Verpackung von Medikamenten werden künftig somit riesige Datenmengen entstehen, die es zu handeln und zu archivieren gilt. Hier sind Spezialisten gefragt, die sowohl Hersteller als auch Verpackungsdienstleister mit Beratung, Projektmanagement, Qualifizierung und der Bereitstellung von praxiserprobten Track & Trace-Lösungen zur Erfüllung der FMD-Richtlinie unterstützen. Das fängt mit geeigneten Identifikationslösungen an und hört bei Datenbanken und Tools zur Produktverfolgung noch keineswegs auf.
Spezialisten sind gefragt
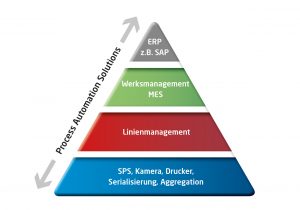
Bild: Process Automation Solutions
Spezialisten mit jahrelanger Erfahrung mit Automatisierungslösungen im Bereich Pharmaindustrie und Verpackungstechnik können bei der Umsetzung der FDM-Richtlinie helfen. Sie unterstützen als gesamtverantwortlicher Auftragnehmer die betroffenen Unternehmen von den ersten Konzepten über das Basic und Detail Engineering bis hin zur Montage und Inbetriebnahme.
Eine Umrüstung der Anlage oder Maschine eines Arzneimittelherstellers, Verpackungsdienstleisters oder Maschinenbauers im Sinne der FDM-Richtlinie könnte dann etwa wie folgt ablaufen: Bei einer bereits existierenden Anlage bzw. Maschine steht am Anfang eine Bestandsaufnahme. Alle gesammelten Daten werden analysiert und die benötigten Serialisierungssysteme ausgewählt. Hier ist Überblick gefragt, um herstellerunabhängig wirklich die für die jeweilige Applikation am besten geeignete Lösung zu finden. Die langjährige Erfahrung hat dabei gezeigt, dass die Erstellung der entsprechenden Lastenhefte (User Requirement Specifications, kurz URS) keineswegs trivial ist. Eine gute, praxisgerechte Strukturierung erfordert eine gehörige Portion Know-how. Ist diese „Hürde“ gemeistert und das passende System für die Serialisierung gewählt, erstellen die Automatisierungsspezialisten in enger Zusammenarbeit mit den Betreibern ein Pflichtenheft, das die Grundlage für die Realisierung bildet. Ähnlich ist der Ablauf bei einem neuen Projekt, nur dass es keine Bestandsaufnahme gibt.
Jetzt geht’s zur Sache

Bild: Process Automation Solutions
In der anschließenden Designphase geht es dann zur Sache: Die Spezialisten klären, welche Spezifikationen die einzelnen Automatisierungskomponenten erfüllen müssen, also z.B. die Etikettendrucker und die für die Erfassung notwendigen Kamerasysteme. Welche Schnittstellen sind notwendig, was muss das Datenhandling leisten, welche Daten müssen wann und wo verfügbar sein? Falls gewünscht, ist ein Datentransfer von der Feldebene bis ins ERP-System realisierbar. Die notwendige Hardware wird ausgewählt, bepreist und beschafft; Experten konfigurieren die Software. Dann gilt es, Druckvorlagen zu erstellen, Schaltschränke zu konzipieren und zu bauen etc. Ist das alles erledigt, kann der Factory Acceptance Test (FAT) starten, also die Funktionsprüfung der Anlage beim Automatisierer oder direkt beim Hersteller bzw. Betreiber. Dabei werden alle Anlagenfunktionen Schritt für Schritt getestet und sämtliche Einzelheiten demonstriert und dokumentiert.
Vor der eigentlichen Inbetriebnahme mit Integration in die IT-Umgebung steht dann noch der sogenannte SAT (Site Acceptance Test). In diesem wird die gesamte Anlage auf Sicherheit und Funktion überprüft, wobei alle Details präzise dokumentiert werden. Nach abgeschlossener Validierung kann die Anlage oder Maschine dann in Betrieb gehen. Die FDM-Richtlinie ist umgesetzt; Training und Schulungen der Mitarbeiter können, um wertvolle Zeit zu sparen, schon während der Testphasen parallel starten. Falls gewünscht, kümmern sich die Automatisierungsspezialisten natürlich auch danach noch um die neue oder modernisierte Anlage und unterstützen den Betreiber mit umfangreichen Serviceleistungen.
Die Zeit vergeht schneller als man denkt
Während die meisten großen Arzneimittelhersteller bereits mit der notwendigen Umstellung begonnen haben, stehen bei kleineren Betrieben und Verpackungsdienstleistern oft entsprechende Maßnahmen noch aus. Hier wird es jetzt höchste Zeit zum Handeln. Eine End-to-End-Verifizierung jeder einzelnen Arzneimittelpackung ist für jeden Betrieb schon heute realisierbar. Mit kompetenter Unterstützung bleibt der zeitliche Rahmen für eine richtlinienkonforme Anlagenauslegung überschaubar. Bekanntlich vergeht die Zeit ja schneller als man denkt, und der Februar 2019 wird eher da sein als erwartet.
Titelbild: Process Automation Solutions
